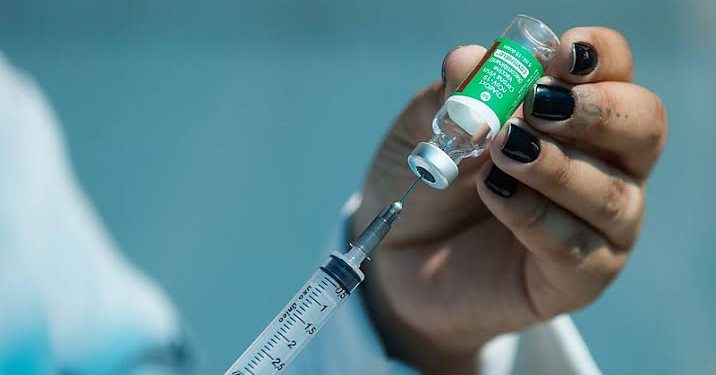
O Brasil acaba de receber um dos maiores avanços recentes no combate ao HIV. Trata-se do cabotegravir de longa ação, medicamento injetável da farmacêutica GSK que será comercializado sob o nome Apretude. Registrado pela Anvisa em 2023, o fármaco atua como profilaxia pré-exposição (PrEP) e se mostrou 100% eficaz nos estudos clínicos, segundo a fabricante.
Aplicado a cada dois meses, o Apretude chega ao mercado privado como alternativa aos comprimidos orais diários disponíveis no Sistema Único de Saúde (SUS) desde 2017. Especialistas afirmam que a grande revolução não está apenas na eficácia, mas na facilidade de adesão, já que muitas pessoas abandonam a prevenção justamente pela necessidade de uso contínuo de pílulas.
Impacto no cenário brasileiro
Segundo o Ministério da Saúde, o país registrou 46,5 mil novos casos de HIV em 2023. Mesmo com a PrEP oral, análises preditivas estimam que o Brasil pode acumular 600 mil novas infecções nos próximos 10 anos. Para a infectologista Beatriz Grinsztejn, chefe do Laboratório de Pesquisa Clínica em IST/HIV/Aids da Fiocruz, o cabotegravir pode mudar esse cenário:
“Em um estudo com 1.200 voluntários no Brasil, 83% optaram pelo cabotegravir quando ele foi oferecido junto a outras opções. A aceitação foi excelente”, afirma.
Atualmente, o medicamento ainda não foi incorporado ao SUS. A decisão depende de negociações entre o governo e o laboratório, conduzidas pela Conitec (Comissão Nacional de Incorporação de Tecnologias), que avalia principalmente o custo.
Avanços internacionais
Enquanto o Brasil discute a incorporação do cabotegravir, a Europa e os Estados Unidos deram um passo além. A Agência Europeia de Medicamentos (EMA) e a FDA, nos EUA, já aprovaram o lenacapavir, injeção que precisa ser aplicada apenas duas vezes ao ano. Os estudos clínicos publicados no The New England Journal of Medicine mostraram praticamente zero casos de infecção entre milhares de participantes.
Esse fármaco ainda não está disponível no Brasil, mas a fabricante Gilead Sciences já solicitou registro à Anvisa em abril deste ano.